1. Parameter aus Blut, Serum, Plasma und Co
1.1 Einleitung
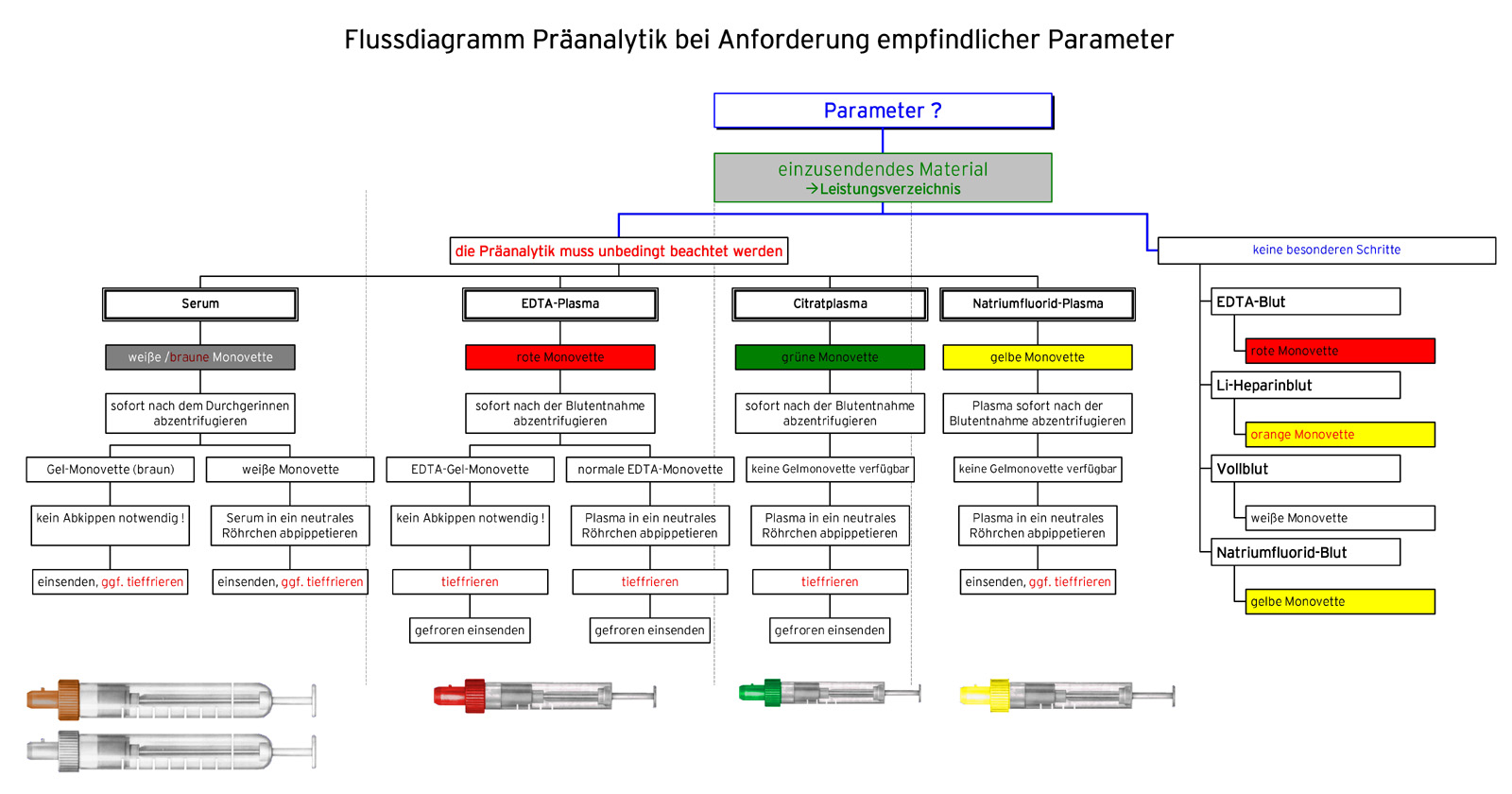
Die Bestimmung der meisten im Labor angeforderten Parameter erfolgt aus venösem Blut. Je nach Parameter muss das Blut entweder zuvor komplett durchgerinnen oder an der Gerinnung gehindert werden.
Den von den Gerinnungsfaktoren befreiten, flüssigen Anteil des Blutes, der entsteht, wenn durchgeronnenes Blut abzentrifugiert wird, bezeichnet man als Serum. Wird das frische Vollblut durch Zusatz verschiedener Substanzen an der Gerinnung gehindert, entsteht kein Koagel, die Zellen bleiben einzeln im Plasma, wie der flüssige Anteil des Blutes bezeichnet wird, der noch alle Gerinnungsfaktoren enthält. Je nach Zusatz wird das Plasma dann als EDTA-, Citrat-, NaF- oder Heparinplasma bezeichnet.
Das Verweilen des Serums oder des Plasmas über dem Blutkuchen bzw. den zellulären Bestandteilen des Blutes führt bei der Messung bestimmter Parameter zu falschen Ergebnissen. Deshalb muss das Plasma oder das Serum in diesen Fällen von den zellulären Bestandteilen getrennt werden.
Für die Trennung in der Praxis gibt es sog. Gel-Monovetten. Das darin enthaltene Gel liegt in der Dichte zwischen den zellulären Bestandteilen und dem Serum/Plasma. Es legt sich bei der Zentrifugation als absolut dichte Trennschicht über die Zellen. Ein Abpipettieren kann somit entfallen. Muss das Serum bzw. das Plasma tiefgefroren werden, kann dies in der Gel-Monovette erfolgen. Bitte beachten Sie, dass das Gel seine Wirkung erst nach der Zentrifugation entfaltet. Das Zentrifugieren muss daher rasch nach dem Durchgerinnen (Serum) bzw. sofort nach der Entnahme (Plasma) erfolgen.
Zur Bestimmung von Laborparametern, für deren Bestimmung die Trennung des Serums oder Plasmas von den zellulären Bestandteilen unbedingt notwendig ist, folgen hier einige allgemeine Vorbemerkungen, die den Hintergrund des danach beschriebenen präanalytischen Aufwandes für einige Parameter etwas verdeutlichen sollen.
1.1.1 Entnahme des Blutes
Die Blutentnahme sollte mit möglichst dicken Kanülen erfolgen (optimal: 20 G, gelb), um eine Hämolyse durch die Scherkräfte, die durch die starke Beschleunigung in der Nadel während der Aspiration (Ziehen am Stempel) auftreten, zu vermeiden.
Die Blutentnahme erfolgt, wenn möglich, in der Ellenbeuge. Wenn sich dort keine sicher tastbare Vene findet, sollte das Blut besser am Handrücken entnommen werden, anstatt in der Ellenbeuge „herumzustochern“.
Zwischen Stauen und Punktion sollte nicht zu viel Zeit vergehen, das Desinfizieren der Einstichstelle sollte daher schon vor der Stauung erfolgen. Da bei Citratblut ein bestimmtes Mischungsverhältnis zwischen entnommenem Blut und der in der Monovette befindlichen Citratlösung einzuhalten ist, sollte dieses nicht als erstes entnommen werden, um keine Luft zu aspirieren – dies gilt besonders bei Verwendung von Butterflies.
Bei Entnahme mehrerer Röhrchen wird folgende Reihenfolge empfohlen:
- Blutkulturen
- Vollblut für Serum
- Citratblut
- Heparinblut
- EDTA
- weitere
1.1.2 Beschriftung der Proben
Auf jedem Probengefäß sollte neben dem Vor- und Zunamen auch das Geburtsdatum des Patienten vermerkt sein.
Bei Untersuchungen, die nicht dem Gendiagnostik-Gesetz (GenDG) unterliegen, genügt zur Probenkennzeichnung ein eindeutiger Barcode auf der/den Probe(n) und dem dazugehörigen Anforderungsschein. Hier muss die Probe also nicht mit Namen, Vornamen und Geburtsdatum beschriftet werden. Zur sicheren Identifikation der Probe empfehlen wir jedoch immer eine Beschriftung wie oben beschrieben. (Für Blutproben, die für eine Blutgruppenbestimmung bzw. eine genetische Untersuchung abgenommen werden siehe Kapitel 1.4.)
Bei Stimulations- oder Suppressionstests bzw. bei Tagesprofilen müssen die Proben zusätzlich so gekennzeichnet sein, dass eine eindeutige Probenidentifikation möglich ist (Uhrzeit, vor/nach Gabe etc.).
Nur wenn alle Proben einer seriellen Abnahme mit einem einzigen Anforderungsschein eingesandt werden, ist auch eine Beurteilung der kompletten Serie möglich.
Um eine Verwechslung zu verhindern, muss bei Einsendung von EDTA- und/oder Citrat-Plasma auf dem Probengefäß zusätzlich vermerkt werden, um welches Plasma es sich handelt.
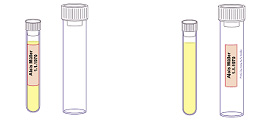
Die Beschriftung muss sich auf dem Probengefäß, das die Probe enthält, und nicht auf der Umverpackung befinden! Dies gilt insbesondere auch für Spezialröhrchen zur Untersuchung von Blut im Stuhl. Werden vom Labor zur Verfügung gestellte Barcodes verwendet, müssen diese immer senkrecht auf die Probe aufgebracht werden, nicht schräg oder horizontal. Überstehende oder schlecht haftende Namensetiketten sind zu vermeiden, da es sonst zu Problemen bei der automatischen Probenverarbeitung kommt.
Abb. 1: Beschriftung der Probengefäße
 | ||
|
Richtig ! Beschriftung auf Probengefäß |
Falsch ! Beschriftung nicht auf Probengefäß | |
Infektiöses Material (z. B. HIV-/TB-/Hepatitis C positiv etc.) muss als solches gekennzeichnet sein; z. B. unter Nennung des Keimes auf dem Anforderungsschein.
1.1.3. Anforderungsscheine
Zu jeder Probe wird ein Anforderungsschein benötigt, der neben dem vollständigen Namen auch das Geburtsdatum, die vollständige Adresse des Patienten sowie den Kostenträger mit allen relevanten Daten enthalten muss. Wurde wenig Material eingesandt und sind mehrere Parameter angefordert, sollte eine Analysenpriorität z. B. durch eine Nummerierung der Parameter angegeben werden.
Probenmaterial ohne einen Untersuchungsauftrag kann nicht bearbeitet werden. Dies sollte im Interesse des Patienten vermieden werden, da es für Nachforderungen aus empfindlichen Materialien zu spät sein kann und diese nicht mehr durchgeführt werden können (z. B. Blutbild, Gerinnungsparameter etc.).
Bei Anforderungen von Medikamentenspiegeln bitte immer angeben, ob es sich um einen Tal- oder Spitzenspiegel handelt.
- Das Blut für den Talspiegel wird immer direkt vor der Medikamentengabe entnommen.
- Der Zeitpunkt für den Spitzenspiegel ist von der Pharmakokinetik und der Applikationsform abhängig. Hier bitte immer Zeitpunkt der Gabe sowie der Blutentnahme auf dem Anforderungsschein angeben.
- Bestimmte Medikamente können nicht aus einer Gelmonovette bestimmt werden, da sich die Substanz im Gel anreichert (siehe Kap. 1.2.2.).
Bitte beachten Sie, dass bei Anforderung humangenetischer Untersuchungen (z. B. Faktor V-Leiden-Mutation, Pharmakogenetik oder 1. Trimester-Screening) die Vorgaben des Gendiagnostikgesetzes (GenDG) beachtet werden müssen. So muss z. B. eine gesetzeskonforme Einwilligung des Patienten vorliegen, bevor wir die Untersuchung durchführen dürfen (weitere Informationen unter https://www.labor-enders.de/gendiagnostik.html).
1.1.4. Nahrungskarenz und Tageszeit
Ganz allgemein sollte eine Blutentnahme nach größeren Mahlzeiten vermieden werden (Ausnahme: Blutzuckertagesprofile), da viele Bestimmungen aus lipämischem Material problematisch sind. Parameter, die durch die Nahrungsaufnahme beeinflusst werden, müssen nüchtern – d. h. nach einer Nahrungskarenz von mindestens 12 h – entnommen werden. Während der Nahrungskarenz darf keine Nahrung zu sich genommen werden. An Getränken ist nur Wasser oder ungesüßter Tee erlaubt.
Die Tageszeit ist nur für einige wenige Parameter, die einer nennenswerten Tagesrhythmik unterliegen, von Bedeutung.
Bei den in Tab. 1 aufgeführten Parametern ist zwischen drei Gruppen zu unterscheiden:
- Bei der ersten muss der Patient lediglich nüchtern (s. o.) sein, die Entnahme sollte, wenn möglich, in den Morgenstunden erfolgen.
- Bei der zweiten Gruppe spielt die genaue Einhaltung der Uhrzeit der Entnahme eine Rolle.
- Bei der dritten Gruppe sind beide Bedingungen zu beachten.
| nüchtern | Entnahme um 8:00 Uhr | nüchtern + Entnahme um 8:00 Uhr |
| • Cholesterin, gesamt | • ACTH | • β-Crosslaps |
| • LDL- Cholesterin | • Cortisol[1]), z. A. einer NNR-Insuffizienz | • Gallensäuren |
| • HDL- Cholesterin | ||
| • Triglyceride | ||
| • Nüchtern-Blutzucker | ||
| • Phosphat | ||
| • Homocystein |
Bei Entnahme diverser Tagesprofile (Blutzucker, Cortisol
u. a.) ist zwar auf die Einhaltung der jeweiligen Uhrzeiten zu achten,
eine Nahrungskarenz ist jedoch nicht notwendig.
[1] Z. A. eines M. Cushing sollte die Entnahme um 24:00 Uhr bzw. möglichst wenig früher erfolgen.
1.1.5. Lichtgeschützter Transport
Werden Parameter angefordert, die unter der Einwirkung von Licht zerfallen (siehe Tab. 2), sollte der Transport lichtgeschützt – z. B. mit Alufolie umwickelt oder zumindest in einer lichtdichten Umverpackung – erfolgen.
| lichtgeschützter Transport |
| • Vitamin A |
| • Vitamin E |
| • Bilirubin |
1.2. Serum
Aus dem durch Punktion des Patienten gewonnenen Vollblut wird erst durch den Gerinnungsvorgang und anschließendes Zentrifugieren das Serum erzeugt.
Die stabilsten Parameter sind in der Regel Proteine, die keine Enzymfunktion haben, wie z. B. Immunglobuline (als Gesamt-IgG oder spezifisch in der Serologie, IgE usw.) oder Albumin. Sie sind gegen Verweilen auf dem Blutkuchen ziemlich unempfindlich.
Dies gilt auch für die meisten Ionen und Reste anorganischer Säuren, die innerhalb der Erythrozyten und außerhalb im Serum oder Plasma in etwa der gleichen Konzentration vorhanden sind.
| Serum | Serum, gefroren |
| • Kalium | • Aldosteron |
| • GOT | • Calcitonin |
| • LDH | • CH 100-Aktivität |
| • Eisen | • Folsäure |
| • Zink | • Gastrin |
| • IGF 1 | |
| • IGF-BP3 | |
| • Insulin | |
| • IL 8 | |
| • S100 | |
| • Vitamin A | |
| • Vitamin B 6 | |
| • Vitamin C | |
| • Vitamin E |
Andere Parameter, wie z. B. Kalium oder Phosphat, sind in Erythrozyten deutlich höher konzentriert als im Serum und werden durch die aufgrund der Hypoxie einsetzende Hämolyse im Serum falsch hoch gemessen.
Bei Einsendung von Vollblut können auch Eisen-Spiegel aufgrund möglicher Hämolyse falsch hoch sein. Ein verlässlicher Wert kann nur bei Einsendung von Serum gemessen werden.
Um verlässliche Werte zu ermitteln, reicht es aus, das Serum entweder durch Überführen in ein neutrales, beschriftetes Röhrchen oder die Verwendung einer Gel-Monovette und anschließender Zentrifugation von den Zellen zu trennen.
Für Enzyme und Hormone ist die Stabilität im Plasma bzw. Serum stark von der Funktion im Körper abhängig. Viele Hormone, wie z. B. Cortisol, FSH oder Östradiol, sind sehr lange stabil.
Als Beispiel für ein sehr instabiles Hormon sei hier Insulin beschrieben. Dieses Hormon muss in vivo nach einer Kohlenhydrat-reichen Mahlzeit den Blutzuckerspiegel rasch normalisieren, diese Funktion aber zeitlich stark begrenzt ausüben. Andernfalls wäre eine ausgeprägte Hypoglykämie die Folge. In vivo gibt es daher im Plasma Enzyme, die Insulin rasch abbauen. Die Halbwertszeit des Insulins liegt in vivo unter 10 Minuten.
Werden die angeforderten Parameter wie z. B. Insulin von nicht-Calcium-abhängigen Enzymen abgebaut, muss das Serum sofort nach dem Durchgerinnen abzentrifugiert, vom Blutkuchen getrennt und tiefgefroren werden. Werden Gel-Monovetten verwendet, können diese nach der Zentrifugation ohne Abkippen tiefgefroren werden (s. Tab 3).
1.2.1. Hinweise zur Zentrifugation von Serum-Gel-Monovetten
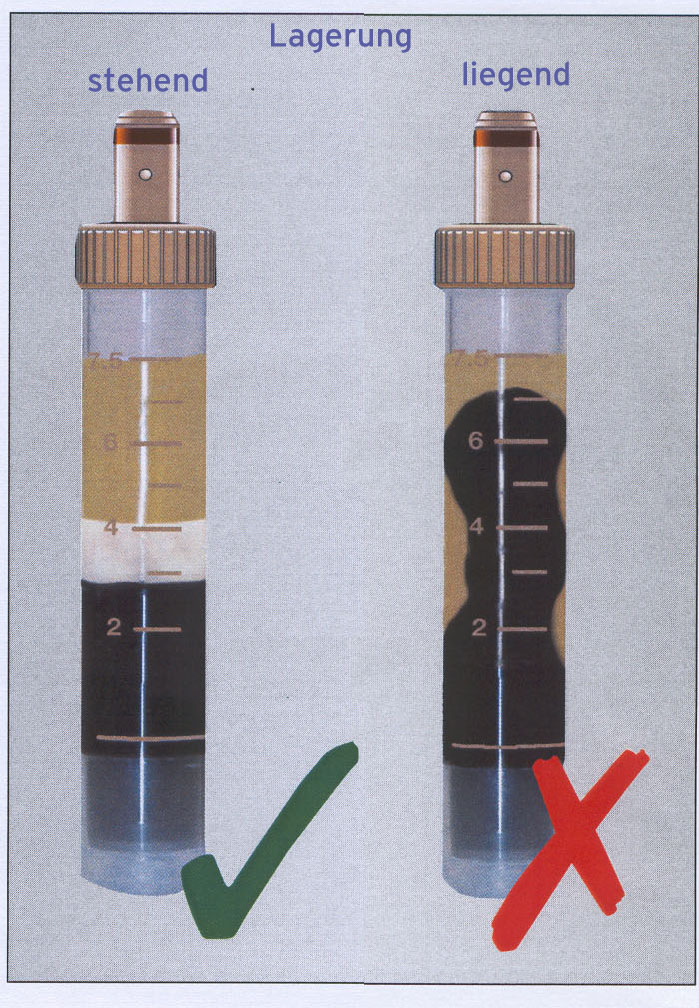
Das unter diesem Punkt für Serum-Gel-Monovetten beschriebene Vorgehen gilt auch für EDTA- und Li-Heparin-Gel-Monovetten. Lediglich die abweichende RZB (Relative Zentrifugal-Beschleunigung, s. Abb. 3) muss berücksichtigt werden.
Die Serum-Gel-Monovetten sollten in den ersten 15 Minuten nach der Blutentnahme stehend gelagert werden, da es sonst zu einer sog. „Wurstbildung“ kommt, die während der Zentrifugation die Ausbildung der Gelschicht – besonders bei starren Rotoren – behindert.
Serum-Gel-Monovetten können wie in Abb. 3 beschrieben zentrifugiert werden. Die einzustellende Drehzahl hängt vom Radius der verwendeten Zentrifuge ab. Wenn r der Radius in cm und n die Umdrehungen/min sind, gilt für die Relative Zentrifugalbeschleunigung RZB in g (DIN 58970-2) folgende Gleichung:
RZB [g] = 0,00001118 x r x n²
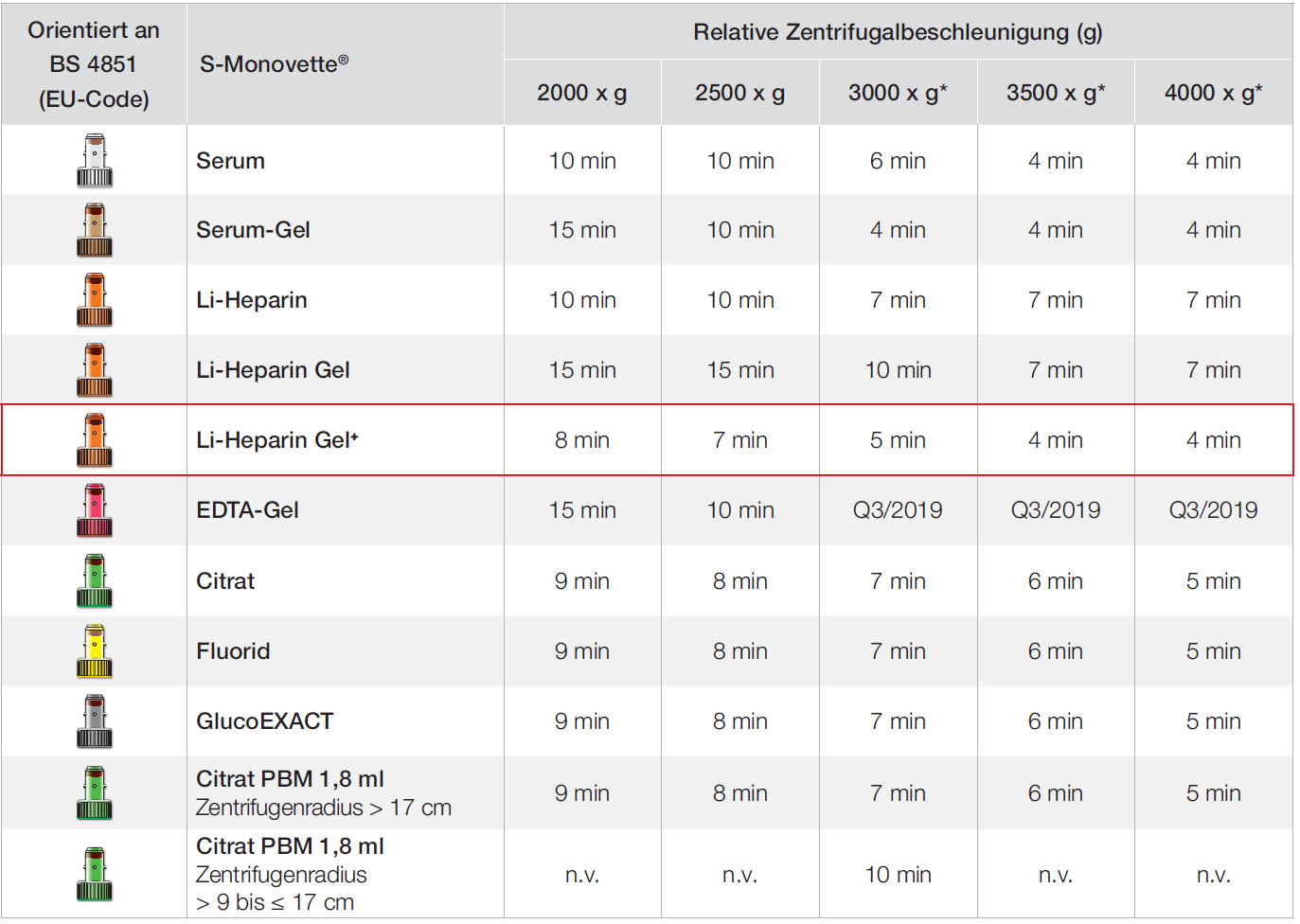 Abb. 3: Zentrifugationsempfehlung für verschiedene Monovetten
Abb. 3: Zentrifugationsempfehlung für verschiedene Monovetten
(n.v. = nicht validiert, * Gilt für alle S-Monovetten mit Ausnahme Ø 8 mm (S-Monovetten Pädiatrie), Zentrifugation bei 20ºC)

Dabei kann der Radius r aus der Gebrauchsanweisung der Zentrifuge entnommen oder selbst ermittelt werden (s. Abb. 4). So werden z. B. bei einer Labofuge 200 von Heraeus (Radius 9,65 cm) 2.500 g etwa mit einer Drehzahl von 5.000/min erreicht.

Nach der Zentrifugation sollte eine durchgängige Gelschicht über dem ganzen Blutkuchen liegen und keine Verbindung mehr zwischen Blutkuchen und Serum bestehen. Dies ist bei Ausschwing-Rotoren immer gewährleistet. Bei Festwinkel-Rotoren sollte das Ergebnis wie auf der nebenstehenden Abbildung aussehen. Bestehen Zweifel, ob die Gelschicht den Blutkuchen sicher von Serum trennt, das Serum bitte nach der Zentrifugation in ein beschriftetes Neutralröhrchen abkippen.
>1.2.2. Parameter die nicht aus Serum-Gel-Monovetten bestimmt werden können
Einige Medikamentenspiegel lassen sich nicht aus Serum-Gel-Monovetten bestimmen, da sie sich mit der Zeit an das Gel anlagern und dadurch falsch niedrige Spiegel bestimmt werden. Bei Anforderung dieser Spiegel empfehlen wir, das Serum 30 min nach Abnahme zu zentrifugieren, abzutrennen und dieses in ein Neutralröhrchen zu überführen. Eine Auswahl von Medikamenten, die nicht aus Gelmonovetten bestimmt werden sollten enthält Tab. 4.
| A | Alprazolam Amiodaron/Desmethylamiodaron Amisulprid Amitriptylin/Nortiptylin Amoxicillin Aripiprazol Atenolol Atomoxetin |
| B | Benperidol Biperiden Bisoprolol Bromazepam |
| C | Chlordiazepoxid Chlorprothixen Citalopram/Escitalopram Clobazam/Desmethylclobazam Clomipramin/Norclomipramin Clonazepam Clozapin/Desmethylclozapin |
| D | Demoxepam Des-N-Methylsuximid Diazepam/Nordiazepam Dibenzepin Diclofenac Doxepin/Desmethyldoxepin Dronedaron Duloxetin |
| E | Escitalopram |
| F | Fentanyl Flecainid Flunitrazepam Fluoxetin/Norfluoxetin Flupentixol Fluphenacin Flurazepam Fluvoxamin |
| G - H | Haloperidol |
| I - J | Imatinib Imipramin/Desipramin |
| K | Ketazolam |
| L | Lamotrigin Lorazepam Lormetazepam |
| M | Maprotelin Medazepam Methotrexat Methylphenidat/Ritalinsäure Metoprolol Mexiletin Mianserin Midazolam Mirtazapin Mitotan Moclobemid |
| N | Nitrazepam |
| O | Olanzapin Opipramol Oxazepam Oxcarbazepin |
| P | Paroxetin Perazin Pipamperon Promethazin Propafenon |
| Q | Quetiapin |
| R | Reboxetin Risperidon/9-OH-Risperidon |
| S | Sufentanyl |
| T | Temazepam Tetrazepam Thiopental Tiaprid Tramadol/Desmethyltramadol Tranylcypromin Trazodon Triazolam Trifluoperazin Trimipramin/Nortrimipramin |
| U - V | Venlafaxin/Desmethylvenlafaxin |
| W- Z | Ziprasidon Zolpidem Zopiclon |
1.2.3 Versand von gefrorenem Serum
Hierzu siehe bitte Kapitel 1.6.2 Gefrorener Versand
1.3. EDTA-Plasma
Viele Parameter, wie z. B. ACTH oder PTH, werden von Calcium-abhängigen Enzymen abgebaut. Da das zugesetzte EDTA Calcium komplexiert („bindet“) und somit den Enzymen entzieht, ist der Abbau vieler empfindlicher Parameter in EDTA-Blut vermindert, man gewinnt daher gegenüber dem Serum etwas zeitlichen Spielraum. Um die Enzymaktivität zum Stillstand zu bringen, wird anschließend noch abzentrifugiert und das Plasma tiefgefroren. Die Trennung von den zellulären Bestandteilen ist notwendig, da beim Tieffrieren die Erythrozyten zur kompletten Hämolyse gebracht würden. Somit würden das Hämoglobin und alle Enzyme aus Erythrozyten frei werden und könnten ihrerseits wiederum die Bestimmung stören oder den Parameter abbauen.
Alle Parameter, bei denen im Untersuchungsprogramm nur EDTA-Plasma als Material angegeben ist, sind i. d. R. sehr empfindlich und müssen unbedingt (s.Tab. 5):
- in einer EDTA-Gel-Monovette (hilfsweise auch ohne Gel) abgenommen werden,
- nach der Entnahme sofort abzentrifugiert werden
- und können bei Verwendung einer EDTA-Gel-Monovette in der Entnahme-Monovette tiefgefroren werden. Diese Proben sollten aufrecht stehend 24 Stunden durchfrieren.
- Bei der Verwendung von EDTA-Monovetten ohne Gel muss das Plasma vor dem Einfrieren noch in ein beschriftetes neutrales Röhrchen (Abb. 24) pipettiert werden (Vorsicht – keine Erythrozyten mit überführen ⇒ 1 mm Plasma stehen lassen!). Auch diese Proben sollten aufrecht stehend 24 Stunden durchfrieren. Bitte die Probe auch mit EDTA-Plasma beschriften, da Plasma optisch nicht von Serum zu unterscheiden ist.
Da EDTA-Monovetten Kalium-EDTA (K4-EDTA) enthalten, ist eine Kaliumbestimmung aus EDTA-Plasma nicht möglich (Die gemessenen Werte liegen über 20 mmol/l). Ebenso ist die Aktivitätsbestimmung von Enzymen, die ihrerseits Calcium-abhängig sind, aus EDTA-Plasma nicht möglich.
Werden in den Testreagenzien 2-wertige Kationen verwendet, die auch von EDTA komplexiert werden, kann ebenfalls keine Bestimmung aus EDTA-Plasma erfolgen.
| EDTA-Plasma, gefroren | |
| • Katecholamine | • Gastrin |
| • Adrenalin | • Glucagon |
| • Noradrenalin | • Homocystein |
| • Adrenocorticotropes Hormon ACTH | • Parathormon (intakt) |
| • Ammoniak | • PTHrP |
| • Antidiuretisches Hormon ADH | • Renin |
| • 5-S-Cysteinyl-DOPA | • Serotonin |
| • VIP | |
| • Metanephrine/ Normetanephrine |
1.3.1. Hinweise zur Gewinnung von EDTA-Plasma
Hierzu siehe bitte Kapitel 1.6.1. Hinweise zur Gewinnung von Citrat- oder EDTA-Plasma.
1.3.2. Hinweise zum Versand von gefrorenem EDTA-Plasma
Hierzu siehe bitte Kapitel 1.6.2.
1.4. EDTA-Blut
Die häufigste Anwendung für EDTA-Blut ist die Beurteilung der Zellen des Blutes. EDTA-Monovetten haben eine rote Kappe. EDTA-Blut wird für das herkömmliche Blutbild (maschinell/mikroskopisch) und die weitergehende Durchfluss-zytometrische Analyse der Lymphozyten (z. B. die Bestimmung der CD4+-T-Helferzellen bei HIV-Infektionen) benötigt. Die Zellen sind in diesem Medium nur begrenzt stabil, EDTA-Blut älter als 24 h (gilt nur, wenn bei Raumtemperatur gelagert wurde) sollte daher nicht mehr für die Beurteilung der Zellen herangezogen werden.
Auch für die Bestimmung der Blutgruppe, die Blutkörperchen-Senkungs-Geschwindigkeit (BSG) und zum Nachweis von Hb-Varianten (z. B. HbA1c oder Hb-Elektrophorese) wird EDTA-Blut verwendet.
Für die Bestimmung der Blutgruppe muss eine separate 7,5 ml EDTA-Monovette eingesandt werden, die mit Namen, Vornamen und Geburtsdatum beschriftet ist.
Zum Nachweis von Punktmutationen (z. B. Faktor V-Leiden-Mutation oder dem Hämochromatose-Gen C282Y) wird die DNA des Patienten benötigt. Diese ist einfach und sicher aus den Leukozyten im EDTA-Blut zu gewinnen. Die genomische DNA ist in EDTA-Blut bei RT über mehrere Tage stabil. Bei Anforderung genetischer Untersuchungen sollte das EDTA-Blut nicht abzentrifugiert werden.
Für genetische Untersuchungen ist es – wie für die Blutgruppenbestimmung – unabdingbar, dass die Monovette mit Namen, Vornamen und Geburtsdatum beschriftet ist.
Hierbei sind die Vorgaben des Gendiagnostikgesetzes (GenDG) zu beachten – so muss z. B. eine gesetzeskonforme Einwilligung des Patienten für die angeforderten genetischen Untersuchungen vorliegen, bevor ein Labor die Untersuchung durchführen darf. Weitere Informationen unter
https://www.labor-enders.de/gendiagnostik.html
Zum Nachweis von Viren mittels PCR in EDTA-Blut sollte eine eigene Monovette verwendet werden, die für keine weiteren Bestimmungen vorgesehen ist. Somit wird eine Kontamination durch Öffnen, Pipettieren u. ä. verhindert.
Tieffrieren zerstört die Zellen und macht eine Bestimmung der o. g. Parameter unmöglich!
Das EDTA kann seine gerinnungshemmende Wirkung nur entfalten, wenn es mit dem Blut in Kontakt kommt. Wenn sich die EDTA-Lösung am Boden der Monovette befindet, kann es bei schlechten Abnahmebedingungen zur Gerinnselbildung kommen. Werden die EDTA-Monovetten mit der roten Kappe nach unten gelagert, befindet sich die EDTA-Lösung in der Kappe, das Blut kommt auch bei schlechtem Fluss sofort mit dem EDTA in Kontakt.
1.5. Citrat-Blut
Für Citratplasma gilt im Prinzip das gleiche wie für EDTA-Plasma, doch wird es in der Regel nur für Gerinnungsparameter verwendet, da hier das Plasma 9+1 mit der Citratlösung verdünnt wird und der pH-Wert etwas niedriger liegt. Citrat-Monovetten haben eine grüne Kappe. Da die Monovetten die Citratlösung bereits enthalten, wird das benötigte Mischungsverhältnis nur bei komplett gefüllter Monovette erreicht. Bei Teilfüllung werden alle Parameter pathologisch (s. Abb. 6).
Gerinnungsparameter aus dem Routinelabor, z. B. Quick, PTT oder Fibrinogen, sind einige Stunden in Citratblut stabil und somit bei zeitnahem Transport ins Labor nicht unbedingt zu zentrifugieren, abzupipettieren und tiefzufrieren (s. Tab. 6).
Bis auf den Thrombozytenfunktionstest müssen alle anderen Gerinnungsparameter aus Citratplasma bestimmt werden, das sofort nach der Entnahme abzentrifugiert, von den Zellen getrennt und tiefgefroren wurde.
Der Thrombozytenfunktionstest wird direkt aus Citratblut durchgeführt.
Wurde das Citratblut zentrifugiert, ist diese Bestimmung nicht mehr möglich!
- Bei Anforderung eines Thrombozytenfunktionstests sind daher zwei separate Citrat-Monovetten abzunehmen.
- Die Bestimmung ist bis max. 4 h nach Blutentnahme möglich.
- Eine mechanische Belastung (z. B. heftiges Schütteln) muss vermieden werden.
- Wenn gleichzeitig Gerinnungsparameter angefordert werden, müssen daher 2-3 zusätzliche Citrat-Monovetten eingesandt werden.
Für die Thrombozytenzählung bei V. a. EDTA-induzierte Pseudothrombozytopenie wurde früher auch Citratblut verwendet. Inzwischen kommt eine spezielle Monovette („ThromboExact-Monovette“) zum Einsatz.
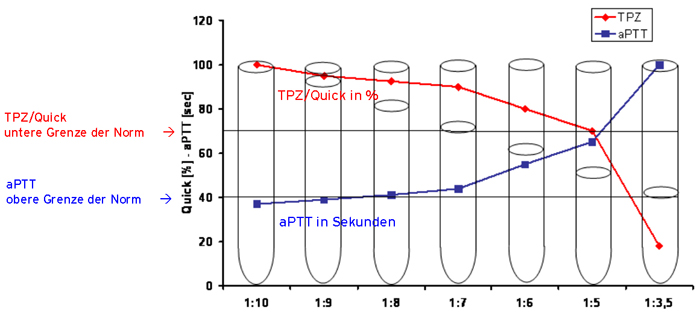
[1] Töpfer et al. Präanalytische Probleme bei Gerinnungsuntersuchungen im venösen Citratblut, Katheterblut und Kapillarblut. J Lab Med 2000; 24: 514-520
1.6. Citrat-Plasma
Alle Parameter, bei denen im Untersuchungsprogramm nur Citratplasma als Material angegeben ist, sind sehr empfindlich und müssen sofort nach der Entnahme…
- abzentrifugiert,
- das Plasma in ein neutrales Röhrchen pipettiert und mit Citrat-Plasma beschriftet
- und tiefgefroren
…werden. Näheres hierzu in Kap. 1.6.1 und 1.6.2.
| nur aus Citratplasma, gefroren | auch aus Citratblut |
| • Anti-Faktor Xa-Aktivität | • innerhalb 4 h |
| • Einzelfaktoren (z. B. Faktor VIII) | ◊Antithrombin |
| • von Willebrand-Faktor-Ag und -Aktivität | |
| • Thrombophilie-Parameter (ohne Genetik) | • innerhalb 8 h |
| • Protein S-Aktivität | ◊Quick (TPZ) / INR |
| • Protein C-Aktivität | ◊ partielle Thromboplastinzeit PTT |
| • APCR (Resistenz gegen aktiviertes Protein C) | |
| • Lupus-Antikoagulans | • innerhalb 12 h |
| • Komplementfaktoren | ◊Plasmathrombinzeit (PTZ) |
| • C1-Esterase-Inhibitor-Aktivität | ◊Fibrinogen |
| ◊D-Dimer (Fibrin- Spaltprodukte) |
Da das Citrat als Natrium-Citrat zugesetzt wird, ist hier eine Natriumbestimmung unmöglich. Ebenso wie in EDTA-Plasma ist die Aktivitätsbestimmung von Enzymen, die ihrerseits Calcium-abhängig sind, aus Citrat-Plasma nicht möglich. Außerdem stört die Verdünnung 9+1.
1.6.1. Hinweise zur Gewinnung von Citrat- oder EDTA-Plasma
Bezüglich des Vorgehens für EDTA-Gel-Monovetten siehe Kap. 1.2.1.

Parameter, die aus Citrat- oder EDTA-Plasma bestimmt werden, sind i. d. R. sehr empfindlich. Das Blut sollte daher direkt nach der Entnahme zentrifugiert werden. Sobald die Zentrifugation beendet ist, muss das Plasma von den Zellen getrennt werden. Da die Zellen im Gegensatz zu durchgeronnenem Vollblut nicht durch Gerinnselbildung verklumpt sind, kann das Plasma nicht einfach in ein neutrales Röhrchen umgekippt werden – es muss vorsichtig abpipettiert werden.
Versehentlich aus dem Blutentnahmegefäß in das neutrale Röhrchen überführte Zellen oder Thrombozyten stören die Messung der zu untersuchenden Parameter. Deshalb wird dringend empfohlen, mindestens 1 mm der Plasmasäule auf den Zellen zu belassen. So wird verhindert, dass bei der Aspiration die Zellen und Thrombozyten aufgewirbelt werden und in das neutrale Röhrchen gelangen (s. Abb. 7).
Da sich Serum, EDTA- und Citrat-Plasma farblich nicht unterscheiden lassen, ist es unbedingt notwendig, auf dem Röhrchen zu vermerken, um welches Material es sich handelt.
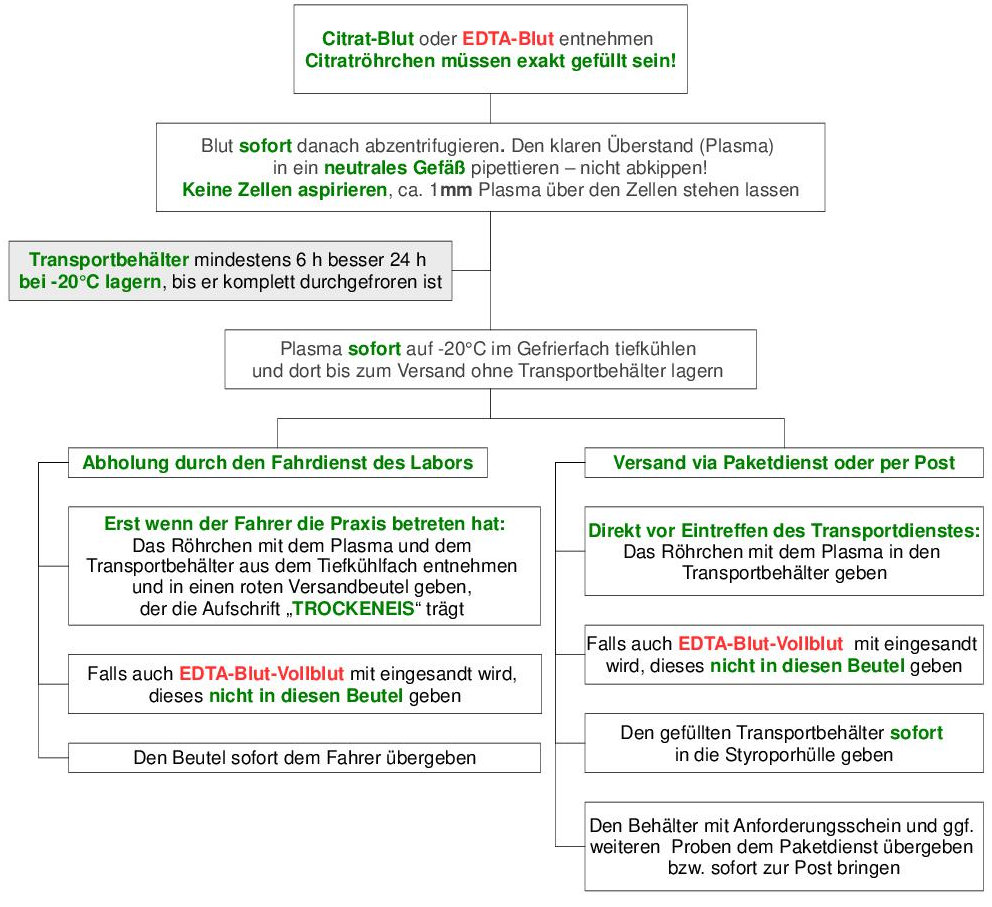
1.6.2. Versand von gefrorenem Plasma, Serum und anderen Materialien
Die abzentrifugierte Serum-Gelmonovette bzw. das neutrale Röhrchen mit Plasma bzw. Serum muss direkt nach der Trennung von den Zellen im Gefrierfach aufrecht stehend deponiert werden, damit es so schnell wie möglich auf mindestens –20 °C abgekühlt wird. Das Neutralröhrchen mit dem Serum bzw. Plasma für mehrere Stunden durchgefrieren lassen.
Ist das erreicht, kann das Röhrchen für viele Tage so gelagert werden. So können Proben, die freitags entnommen wurden, problemlos am Montag dem Fahrer zum Transport auf Trockeneis mitgegeben oder mit dem entsprechenden Versand-System per Post oder Paketdienst versandt werden.
Da der Blutkuchen bei Serum-Gel-Monovetten durch das Gel vom Serum getrennt wird, können diese direkt nach dem Abzentrifugieren eingefroren werden, ohne das ein anderes Gefäß benötigt wird. Dies gilt auch für EDTA-Gel-Monovetten.
Bei Citratblut und EDTA-Monovetten ohne Gel muss das Plasma manuell von den Zellen getrennt werden. Den Ablauf, der strikt eingehalten werden muss, entnehmen Sie bitte dem folgenden Fluss-Diagramm ( Tab. 7):
1.7. Natrium-Fluorid-Blut
Eine andere Möglichkeit, Enzymaktivitäten zu unterbinden, ist das Enzymgift Natrium-Fluorid (NaF). NaF-Monovetten haben eine gelbe Kappe. Hiermit wird der Stoffwechsel zum Erliegen gebracht und die Konzentration diverser Substrate wie Glucose oder Metaboliten wie Lactat oder Pyruvat nicht weiter verändert.
Bei Bestimmung der Glucose aus Serum, das sich bis zum Durchgerinnen oder länger über dem Blutkuchen befand, sind die gemessenen Werte falsch niedrig, da der Blutzuckerspiegel in Vollblut um 90 %/24 h abnimmt. Die Bestimmung der Glucose aus Vollblut oder Serum ist daher obsolet.
Da auch NaF die Glycolyse nicht von Anfang an hemmt, wird inzwischen allgemein empfohlen[1], Glucose nur noch aus Plasma zu bestimmen, das sowohl NaF als auch Citrat enthält (s. Kap.1.7.1. GlucoEXACT-Monovette).
| NaF-Blut |
| Glucose obsolet, nur noch unter Zusatz von Citrat, s. Kap. 1.7.1, unten) |
| · Lactat |
| · Galaktose |
| · Pyruvat |
1.7.1. GlucoEXACT-Monovette
Die GlucoEXACT-Monovette enthält neben NaF auch Citrat. Durch diesen Zusatz wird der initiale Abfall des Glucosespiegels bis zum völligen Eintritt der NaF-Wirkung (nach ca. 30 min) gehemmt. Die Glucose-Spiegel liegen in der GlucoEXACT-Monovette bis zu 10 % höher als in der reinen NaF-Monovette. . Die Kappe der GlucoEXACT-Monovette ist hellgrau.
Die GlucoEXACT-Monovette enthält das Citrat in 400 µl Lösung, daher muss sie — ebenso wie die grüne Citrat-Monovette für die Gerinnung — komplett gefüllt sein. Bedingt durch diese Verdünnung muss der primär gemessene Glucosespiegel mit dem Faktor 1,16 multipliziert werden. Diese Berechnung erfolgt durch unser Labor noch vor der Befunderstellung. Der Glucosewert auf dem Befund muss nicht mehr multipliziert werden.
- 1DG & DGGG Gestationsdiabetes mellitus (GDM): Evidenzbasierte Leitlinie zu Diagnostik, Therapie u. Nachsorge 08/2011
1.8. Spezialmedium für die Bestimmung des Homocysteinspiegels
Für die Bestimmung des Homocysteinspiegel gibt es ein spezielle Monovette, die das Procedere erleichtert, das sich der Versand von gefrorenem EDTA-Plasma erübrigt. Bei Verwendung dieser Spezial-Monovetten HCY Gel ist das Material 8 h ohne Zentrifugation stabil, nach Zentrifugation sogar 96 h. Diese Monovetten haben einen grauen Deckel.
1.8. Lithium-Heparin-Blut
| Lithium-Heparin-Blut |
| · Granulozytenfunktionsteste |
| · Interferon-gamma-release assay (IGRA) für die Tuberkulosediagnostik (T-SPOT.TB) |
| · Toxoplasma gondii-spezifischer ELISPOT |
Bezüglich des Vorgehens für Li-Heparin-Gelmonovetten siehe Kap. 1.2.1.
Dieses Material wird für Untersuchungen der Zellfunktionen von Leukozyten sowie für Chromosomenanalysen benötigt. Die Kappe der Lithium-Heparin-Monovetten ist orange. Das Heparinblut muss spätestens 24 Stunden nach Entnahme im Labor eintreffen. Die Zellfunktionsteste werden an jedem Werktag durchgeführt. Am Freitag muss das Heparinblut für eine Bearbeitung spätestens um 14 Uhr im Labor eintreffen, am Wochenende können die Proben nicht bearbeitet werden. Der Transport erfolgt bei Raumtemperatur. Wegen der Pufferung des pH-Wertes verwenden Sie bitte nur kommerzielle Entnahmeröhrchen. Die Proben dürfen nicht abzentrifugiert werden.
Bitte beachten Sie, dass aus heparinisiertem Blut keine PCR-Diagnostik möglich ist.
2. Parameter aus anderen Materialien (ohne Bakteriologie und Virologie)
2.1 Urindiagnostik
Für den kulturellen Erregernachweis siehe Kap. 3.5, für den viralen Erregernachweis siehe Kap. 4.
Bei der Urindiagnostik muss zwischen 2 Gruppen von Parametern unterschieden werden.
- Parameter, die etwas über den Zustand der ableitenden Harnwege aussagen, z. B. das Sediment mit Kristallen, Leukozyten oder Erythrozyten. Diese Parameter werden i. d. R. nur qualitativ bis semiquantitativ angegeben. Hierzu muss der Urin frisch und ohne Zusätze im Labor eintreffen.
- Die anderen Parameter erlauben eine Aussage über die Ausscheidungsfunktion der Niere bzw. des Organismus. Diese Urin-Parameter werden aus einem 24-h-Urin bestimmt. Falls dies problematisch sein sollte, können bestimmte Werte alternativ auch auf „Gramm Kreatinin“ (z. B. mg/g Krea) bezogen werden. Hierzu muss nur Spontanurin eingesandt werden. Bei der Kreatinin-Clearance wird zusätzlich ein Serum vom Tag der Sammlung benötigt.
Für die Stabilisierung der einzelnen Parameter muss z. T. ein bestimmter pH-Wert eingestellt werden. Dies wird durch den Zusatz bestimmter Säuren erreicht. Andere können nur aus unangesäuertem Urin bestimmt werden. Findet sich das Parameter-Spektrum in mehreren der folgenden Spalten, muss mehrmals gesammelt bzw. – wo möglich – auf die Bestimmung aus Spontanurin ausgewichen werden.
| 24 h-Urin ohne Zusatz oder Spontanurin | 24 h-Urin ohne Zusatz oder Spontanurin + dunkle Lagerung | 24 h-Urin+ HCl 33%ig | 24 h-Urin + Essigsäure 96%ig |
| Kreatinin-Clearance | delta-Amino-Lävulin-Säure | Katecholamine: | 5-Hydroxy-Indol-Essigsäure |
| Proteindifferenzierung: | Porphobilinogen | • Adrenalin | Homovanillinsäure |
| • Gesamteiweiß | Porphyrie-Screening | • Noradrenalin | Vanillinmandelsäure |
| • Albumin | Porphyrin-Differenzierung | • Dopamin | |
| • Transferrin | Metanephrine | ||
| • IgG | Normetanephrine | ||
| • alpha-1-Microglobulin | Ca2+ (Calcium) | ||
| • alpha-2-Makroglobulin | PO4 (Phosphat, pH <3 | ||
| Elektrolyte (Na, K) | Oxalat | ||
| Citrat | |||
| Kupfer | |||
| Xylose | |||
| Cortisol | |||
| Freies Aldosteron | |||
| Aldosteron-18-Glucuronid | |||
2.2 Punktate
Für den kulturellen Erregernachweis siehe Kap. 3.4. Für alle Punktate (z. B. Gelenk-, Zystenpunktat, Aszites oder Pleuraerguss) gelten die gleichen präanalytischen Anforderungen. Für die Beurteilung der Messwerte ist die Angabe des Ursprungs des Punktates unabdingbar.
2.2.1 Klinisch-chemische Parameter aus Punktaten
Punktate sollten immer in 2 verschiedenen Entnahmesystemen eingesandt werden (s. Pkt. 2.2.2):
- In einem neutralen Röhrchen, um alle klinisch-chemischen Parameter – bei Gelenkpunktaten eventuell auch die Kristalle – zu bestimmen.
- Es ist zu beachten, dass bei sehr speziellen Fragestellungen (z. B. Tumormarker im Pleurapunktat) nicht für alle Parameter Normwerte existieren.
2.2.2 Zelluläre Bestandteile aus Punktaten
- Ein Teil des Punktates in einer EDTA-Monovette einsenden. Hierdurch wird eine Adhäsion der Zellen vermieden, deren Zahl sonst falsch niedrig gemessen werden könnte.
- Aufgrund der begrenzten Lebensdauer der Zellen muss die Beurteilung noch an Tag der Entnahme erfolgen.
2.3 Liquor-Diagnostik
Für den kulturellen Erregernachweis siehe Kap. 3.3., für den viralen Erregernachweis siehe Kap. 4.
Für Liquorproben sollten immer Polypropylen-Röhrchen – und keine Gefäße aus Polystyrol – verwendet werden, da die enthaltenen Proteine ansonsten an die Wand der Röhrchen binden und nicht mehr für die Bestimmung bereit stehen.
2.3.1 Liquor-Parameter, die rasch nach der Gewinnung bestimmt werden müssen
Eine Liquorprobe für Parameter, die möglichst sofort nach dem Gewinnen bestimmt werden müssen, sollte zeitnah (<4 h, optimal <2 h) im Labor eintreffen. Hierzu bitte nativen Liquor einsenden. Um das Alter der Liquorprobe zum Zeitpunkt der Untersuchung beurteilen zu können, muss auf dem Anforderungsschein immer die Abnahmezeit angegeben werden. Zu diesen zeitkritischen Parametern zählen die Zellzahl, die Zelldifferenzierung, Glucose und Lactat.
2.3.2 Weniger zeitkritische Liquor-Parameter
Für die weitere, über die in Kap. 2.3.1. genannten Parameter hinausgehende, Liquor-Diagnostik muss sowohl Liquor als auch Serum eingesandt werden. Die Blutprobe sollte hierfür zeitgleich mit dem Liquor (z. B. am gleichen Vormittag) entnommen werden.
Dies gilt für die Bestimmung der Blut-Liquor-Schranken-Funktion (Albumin-Quotient), Nachweis autochthon d. h. intrathekal gebildeter Immunglobuline (IgG-, IgM-, IgA-Quotient, oligoklonale Banden) und spezifischer Antikörperindices zum Nachweis einer autochthonen Immunantwort gegen einen bestimmten Krankheitserreger (z. B. bei Borreliose, HSV, VZV, Syphilis oder auch der „MRZ-Reaktion“ bei V. a. Enzephalomyelitis disseminata).
Daneben besteht die Möglichkeit des Erregernachweises mittels PCR (z. B. bei HSV, Enteroviren, VZV etc.). Um Kontaminationen zu vermeiden, darf die Liquor-Probe nach der Entnahme nicht mehr geöffnet werden.
Für eine adäquate Diagnostik werden 2 ml Liquor benötigt. Einige Bestimmungen sind auch bei Einsendung geringerer Liquor-Mengen (z. B. 500 µl) möglich. Für eine Blut-Liquor-Schranke (nur Albumin) werden mindestens 400 µl benötigt, für eine Abklärung der intrathekalen Ig-Produktion nach Reiber mindestens 500 µl. Für den kulturellen Erregernachweis siehe Kap. 3.3.
2.4. Stuhldiagnostik
Für den kulturellen Erregernachweis siehe Kap. 3.8.
Für die nicht-bakteriologische Stuhldiagnostik wird immer frischer nativer Stuhl benötigt. Viele dieser Parameter werden auf 1 g Stuhl bezogen. Hierfür müssen bestimmte Stuhl-Monovetten verwendet werden, deren Löffel so beschaffen ist, dass er ca. 1 g Stuhl aufnimmt.
Der Stuhl sollte das Labor am Tage der Gewinnung erreichen. Wir bitten daher auf eine Gewinnung an Sonn- und Feiertagen zu verzichten. Lässt sich dies nicht vermeiden, müssen diese Stühle bis zum nächsten Werktag tiefgefroren werden. Für die Bestimmung von Blut im Stuhl sind iFOBT-Spezialröhrchen zu verwenden, die entsprechend der beiliegenden Anleitung befüllt werden müssen (NICHT überfüllen). Außerdem ist das Röhrchen selbst (nicht die beiliegende Tüte etc.) mit Namen, Vornamen oder einem Barcode zu beschriften.
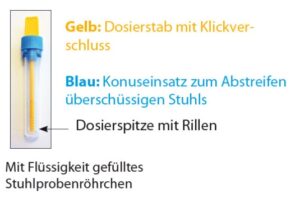
 | • Dosierstab herausziehen • Den oberen gelben Deckel vom Probenröhrchen aufdrehen und den daran befindlichen Dosierstab herausziehen. • Die Flüssigkeit NICHT aus dem Probenröhrchen ausschütten! • Der blaue Konuseinsatz bleibt verschlossen auf dem Röhrchen! |
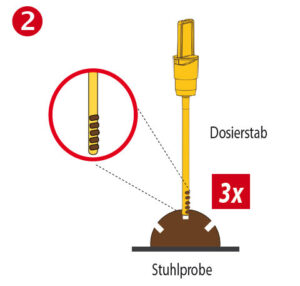 | • Stuhlprobe aufnehmen • Den Dosierstab 3-mal an verschiedenen Stellen einer Stuhlprobe einstechen. • Die Rillen der Dosierspitze müssen sich dabei mit Stuhl füllen. |
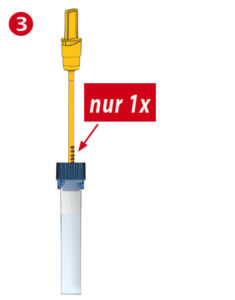 | • Dosierstab nur einmal zurückführen • Den Dosierstab mit der daran anhaftenden Stuhlprobe einmal zurück in das Stuhlprobenröhrchen stecken und nicht wieder herausziehen. • Der überschüssige Stuhl wird dabei an der engen Öffnung des blauen Konuseinsatzes abgestreift. • Bitte beachten: Es darf nur diese kleine, definierte Stuhlmenge am Dosierstab in das Röhrcheninnere gelangen |
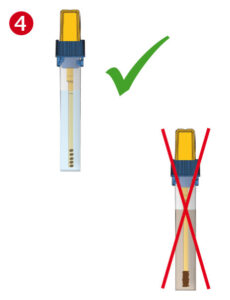 | • Dann drehen Sie das Röhrchen so zu, dass der gelbe Verschluss hörbar einrastet. • Bitte beachten: Die Stuhllösung im Röhrcheninneren verfärbt sich nahezu gar nicht. • Wenn der Dosierstab allerdings mehr als einmal in das Röhrcheninnere eingebracht wird, verfärbt sich, bedingt durch zu viel Stuhl, die Stuhllösung braun, was dazu führt, dass die Probe nicht mehr gemessen werden kann bzw. dies zu einem falsch positiven Ergebnis führt! |
3 Bakteriologie (kultureller Erregernachweis)
3.1 Einleitung
Für bakteriologische oder parasitologische Untersuchungen bitte getrennte Proben in separaten Entnahmegefäßen einsenden.
Die präanalytischen Anforderungen für Proben, die dem kulturellen Erregernachweis dienen, werden im Folgenden für die einzelnen Materialien erläutert.
Bezüglich Lagerung bakteriologischer Proben vor dem Transport gelten folgende Temperaturvorgaben:
| gekühlt (ca. 4-8 °C) | bei Raumtemperatuer (ca. 20-25 °C) |
| • Urinproben | • Abstriche (Wunden, Urethra) |
| • Stuhlproben | • Punktate |
| • Respirationssekrete (Sputum, Trachealsekret, BAL u.a) | • Biopsate |
| • ZVK-Spitzen | • Liquor in System BACTEC® (Blutkulturflasche) |
| • Abstriche | • Blutkulturen (System BACTEC®) |
| • Liquor, nativ (Mikrospkopie & Antigene) |
3.2. Blutkulturen
Blutkulturen dienen dem kulturellen Nachweis von Bakterien/Pilzen im Blut bei V. a. Bakteriämie/Fungämie im Rahmen generalisierter bakterieller Infektionen bzw. bei Sepsis (Ausnahme: Mykobakterien sind nicht in Blutkultur-Flaschen kultivierbar).
Blutentnahme: Die Punktion erfolgt nach sorgfältiger Desinfektion der Punktionsstelle (Einwirkzeit beachten: bei alkoholischen Desinfektionsmitteln 1 min) bevorzugt peripher venös (Blutkultur-Flaschen). Eine Entnahme aus dem ZVK sollte nur im Ausnahmefall durchgeführt werden bzw. bei V. a. Katheterinfektion (unmittelbar vorher oder nachher zusätzlich periphere Blutkulturen entnehmen und jeweils mit Entnahmestelle kennzeichnen).
3.2.1 Entnahme, Lagerung und Transport
- Anzahl: In dringenden Fällen (Sepsis) werden 2–3 Blutkulturen an verschiedenen Punktionsstellen kurz hintereinander entnommen, ggf. wird mit einer kalkulierten Therapie begonnen. Ansonsten 2–3 Blutkulturen über den Tag verteilt entnehmen.
- Beimpfen: Pro Blutkultur wird je eine aerobe und eine anaerobe Flasche mit je ca. 5–10 ml Vollblut beimpft. Die Nachweisrate ist volumenabhängig; deshalb darf ein Volumen von 5 ml nicht unterschritten werden. Auch aerobe Flasche nicht belüften (führt zu Kontamination mit Luftkeimen).
Die Lagerung und der Versand der Blutkultur-Flaschen (BACTEC®) erfolgt bei Raumtemperatur. Eine Vorinkubation im Brutschrank darf nicht durchgeführt werden. Auf dem Begleitschein muss unbedingt Entnahmezeitpunkt und ‑ort vermerkt werden, um eine spätere Zuordnung zu ermöglichen.
Blutkulturen werden generell 5 Tage bebrütet. Bei V. a. Endokarditis wird die Kulturdauer auf 7 Tage verlängert, um auch langsam wachsende Erreger nachweisen zu können. Bei relevanten positiven Blutkulturen erfolgt eine telefonische Mitteilung durch den Mikrobiologen (an Sonn- und Feiertagen gegen 12:00 Uhr).
3.2.2. Beimpfung mit Punktaten
Blutkultur-Flaschen (BACTEC®) können auch mit Punktaten beimpft werden (z. B. Liquor, Pleura-, Gelenk- oder Aszitespunktat). Auch hier erfolgt die Lagerung bis zur Abholung bei Raumtemperatur.
- Wenn eine mikroskopische Beurteilung des Punktates erforderlich bzw. erwünscht ist, zusätzlich einen Teil des Punktates in ein steriles Röhrchen mit Schraubverschluss geben und bei Raumtemperatur lagern / transportieren.
- Für klinisch-chemische Diagnostik (z. B. Zellzahl) zusätzlich noch ein Punktat in EDTA einsenden (s. Kapitel 2.2).
- Für weitere Hinweise zum kulturellen Erregernachweis aus Punktaten siehe auch Kap. 3.4.
3.3. Liquor cerebrospinalis
Bei V. a. bakterielle Meningitis ist der bakteriologische Nachweis der ursächlichen Erreger essentiell. Bitte beachten Sie, dass in diesem Fall immer auch Blutkulturen angelegt werden. Bezüglich der klinisch-chemischen Parameter in der serologischen Diagnostik siehe Kap. 2.2.2.
3.3.1. Entnahme, Lagerung und Transport
Wegen der extremen Anfälligkeit mancher Meningitis-Erreger, insbesondere Meningokokken, gegenüber Umwelteinflüssen (z. B. Abkühlung, Nährstoffmangel) empfiehlt sich folgendes Vorgehen:
- direkt nach der Lumbalpunktion wird die Liquorprobe geteilt
- 500–1.000 µl für klinisch-chemische Untersuchung (Eiweiß, Zucker, Zellzahl, Blut-Liquor-Schranke usw. siehe auch Kap. 2.2.2.) asservieren
- ca. 200 µl Liquor für die bakteriologische Mikroskopie sowie ggf. für den Nachweis von Antigenen in steriles Röhrchen mit Schraubverschluss geben und bis zur Abholung gekühlt lagern
- das restliche Material (mindestens 1.000 µl) zum kulturellen Nachweis in pädiatrische Blutkultur-Flasche verimpfen, diese Flasche nicht belüften (führt zu Kontamination mit Luftkeimen) und bis zur Abholung bei Raumtemperatur lagern
- bei V. a. virale Meningitis keine Blutkultur-Flasche beimpfen, sondern das gesamte Material, welches nicht für die klinisch-chemische Untersuchung benötigt wird, in ein steriles Röhrchen mit Schraubverschluss geben
3.4. Punktate (Pleura-Flüssigkeit, Aszites, Gelenkerguss, Abszess-Aspirat)
Wenn möglich sollten 10–20 ml des Punktates in einem sterilen Schraubröhrchen asserviert werden (siehe auch Punkt 2,Kap. 3.3.1.). Im Labor kann dann bei dünnflüssigen Materialien durch Zentrifugieren eine Anreicherung der häufig nur in geringer Zahl vorhandenen Erreger erreicht werden.
Das häufige Vorgehen, einen Abstrichtupfer mit dem Punktat zu benetzen, diesen einzusenden und den Rest des Punktates zu verwerfen, führt zu einer unnötig niedrigen Nachweisrate.
Abszess-Punktate können auch in der Punktionsspritze mit fest aufgesetztem sterilen Konus verschickt werden (ohne Nadel!).
Vorgehen bei der Entnahme von Gelenkpunktaten:
- erst punktieren, dann therapieren
Grund: Bereits 1 Dosis vor Punktion kann dazu führen, dass sich die Erreger nicht mehr anzüchten lassen. - alkoholisches Desinfektionsmittel vor Punktion verdunsten lassen
Grund: Desinfektionsmittelreste, die bei Punktion in die Probe gelangen, können die Anzucht beeinträchtigen. Wird die Desinfektion mit Jod durchgeführt, muss dieses vor Punktion mit Alkohol abgewischt werden (remanente Wirkung von Jod). - wenn die Probe innerhalb von 3 Stunden im Labor eintrifft (Abholzeiten beachten!) und dort weiter bearbeitet wird, kann die Punktatflüssigkeit (5 ‑ 10 ml) nativ in einem sterilen Röhrchen mit Schraubverschluss transportiert werden. Andernfalls wie folgt vorgehen:
5–10 ml Punktat in eine anaerobe Blutkultur-Flasche spritzen (Gummistopfen vorher mit Alkohol besprühen und trocknen lassen); bei größeren Punktatvolumina 2 Flaschen (anaerob/aerob) beimpfen.
Grund: Das Blutkulturmedium bietet für die in Frage kommenden Erreger optimale Wachstumsbedingungen; zudem kann bei geringer Erregerdichte durch das größere Probenvolumen eine höhere Ausbeute erzielt werden. - Nativmaterial und Blutkultur-Flaschen bei Raumtemperatur lagern und transportieren
- NICHT vorbebrüten
- Blutkultur-Flaschen müssen spätestens 48 h nach Beimpfung im Labor in den Spezialbrutschrank. Die Lagerung und der Transport von Punktaten erfolgt bei Raumtemperatur.
3.5. Urin
Urinkulturen werden bei V. a. Harnwegsinfektion durchgeführt. Bei der Passage des Urins durch die Harnröhre kommt es auch bei Mittelstrahl-Urin häufig zur Kontamination durch Harnröhrenflora. Deshalb wird im Labor eine quantitative Bestimmung durchgeführt.
Wird der Urin durch Blasenpunktion oder Einmal-Katheterisierung gewonnen, muss dies unbedingt auf dem Begleitschein vermerkt werden: In diesen Fällen gelten für die quantitative Beurteilung andere Kriterien als bei Mittelstrahl-Urin oder bei Urin, welcher aus einem Dauerkatheter entnommen wurde.
Bei Patienten mit Dauerkatheter darf die Urinprobe auf keinen Fall aus dem Sammelbehälter entnommen werden! Die Punktion muss nach vorausgegangener Desinfektion des dafür vorgesehenen Gummistopfens im Katheter erfolgen.
3.5.1. Entnahme, Lagerung und Transport
Mittelstrahl-, Punktions- oder Katheterurin wird in einem sterilem Urinbecher aufgefangen. Für das Versenden von Nativurin wird der frisch gewonnene Urin in ein steriles Schraubröhrchen überführt, muss bis zum Transport gekühlt gelagert werden und sollte das Labor möglichst schnell erreichen. Kühlung vermeidet hier das Überwuchern der Infektionserreger durch Kontaminanten (z.B. Standortflora der Harnröhre) und die Vermehrung von potentiellen Infektionserregern, was zu einer falsch hohen Keimzahl führen würde. Es können auch Urin-Borat-Röhrchen verwendet werden, da Borat das unkontrollierte Bakterienwachstum auf dem Transportweg verhindert.
Um die Keimzahl bei der Probenabnahme zu fixieren können Eintauchnährböden verwendet werden. Hierfür wird der Eintauchnährboden vollständig in den Urin eingetaucht, oder bei nicht ausreichender Menge die Agarflächen mittels Pipette beimpft. Bei geringen Urinmengen ist es ausreichend wenn das Universalnährmedium (grün) beimpft wird. Überschüssigen Urin vom Nährboden abfliessen lassen. Darauf achten, dass kein Rest-Urin im Transportbehältnis verbleibt, um eine mehrfache Beimpfung des Nährbodens zu vermeiden. Dies kann zu falsch hohen Keimzahlen führen. Den Nährbodenträger wieder in das mit den Patientendaten beschriftete Röhrchen einführen und verschließen. Eine Vorbebrütung der Nährböden kann in der Praxis durchgeführt werden. Der bewachsene Nährboden sollte schnellstmöglich ins Labor transportiert werden.
3.5.2. Chlamydien- und Neisserien-Nachweis
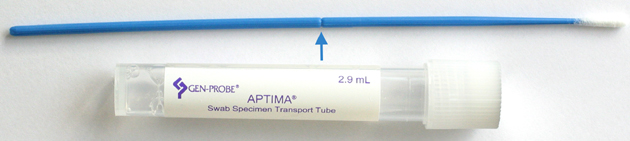
Die Diagnostik erfolgt mittels eines Nukleinsäure-Amplifikationsverfahrens. Hierzu wird eine spezielle Aptima®Urin-Monovette der Firma Hologic benötigt. Im Folgenden finden Sie die Anleitung zur Gewinnung von Urinproben.
Die Patienten sollten vor der Probengewinnung mindestens 1 Stunde lang nicht uriniert haben.
- Die Patientin/den Patienten bitten, etwa 20 ml bis 30 ml Erststrahl-Urin in einem Urinsammelbecher aufzufangen. Das Auffangen größerer Urinmengen könnte zu einer Verringerung der Testempfindlichkeit führen. Patientinnen dürfen den Schamlippenbereich vor der Abgabe der Urinprobe nicht reinigen.
- Das gelbe APTIMA® Probentransportröhrchen mit dem Namen, dem Vornamen und dem Geburtsdatum der Patientin/des Patienten beschriften. Den Schraubdeckel abschrauben und mit der beiliegenden Einwegpipette ca. 2 ml Urin aus dem Sammelbecher in das Probentransportröhrchen überführen (s. Abb. 10a und b). Das zugegebene Urinvolumen ist korrekt, wenn sich der Flüssigkeitspegel zwischen den schwarzen Befüllungslinien auf dem Etikett des Probentransportröhrchens befindet (s. Abb. 10c).
- Das gelbe Probentransportröhrchen nun wieder gut verschließen
- Das beschriftete und mit Urin befüllte APTIMA® Probentransportröhrchen bei 2 °C bis 30 °C lagern und verschicken. Die Proben müssen jedoch nach Entnahme innerhalb von 30 Tagen getestet werden. Ist eine längere Lagerung, bis maximal 90 Tage, erforderlich, müssen die Proben nach der Entnahme bei –20 °C bis –70 °C eingefroren werden.
 |  |  |
3.6. Sekrete aus dem Respirationstrakt: Sputum, Trachealsekret, Bronchial-Lavage (BAL)
Die bakteriologische Untersuchung von Respirationstraktsekreten ist generell nur dann sinnvoll, wenn die Patienten nicht antibiotisch anbehandelt sind. Unter Antibiotika-Therapie können viele Erreger auf den im Labor verwendeten Nährmedien nicht mehr angezüchtet werden, obwohl sie im Patienten u. U. noch vermehrungsfähig sind. Deshalb sollten die Proben möglichst vor Therapie, nach Antibiotika-Pause oder zumindest am Ende eines Antibiotika-Intervalls d. h. direkt vor der nächsten Infusion oder Antibiotika-Gabe abgenommen werden.
Patienten mit Auswurf werden angehalten, vorher eine Mundspülung mit Leitungswasser – auf keinen Fall mit desinfizierendem Mundwasser – durchzuführen, um die Zahl der Kontaminanten aus der Mundhöhle zu reduzieren.
Soll das Sputum auf Mykobakterien untersucht werden, muss die Spülung mit Leitungswasser entfallen, da Leitungswasser Umwelt-Mykobakterien enthalten kann, welche das Ergebnis der Diagnostik verfälschen können!
Die Lagerung und der Transport sollen immer gekühlt (nicht gefroren!) erfolgen, um ein Überwuchern durch Standortflora des oberen Respirationstraktes zu vermeiden.
Das Material wird nativ in den dafür vorgesehenen Behältern (Urinsammelbecher oder Sputumbecher) eingesandt. Soll die Probe auf Chlamydophila pneumoniae oder auf Mycoplasma pneumoniae untersucht werden, wird ebenso verfahren (der Nachweis erfolgt jedoch mit molekularbiologischen Verfahren). Bei Verdacht auf Legionellose muss zusätzlich ca. 5 ml Nativurin in sterilem Schraubröhrchen eingesendet werden (Anforderung: Nachweis von Legionella-Antigen).
Für eine valide Zelldifferenzierung aus der BAL muss das Material das Labor binnen 4 h erreichen.
3.7 Abstriche
Wundabstriche müssen immer in ein bakteriologisches Transportröhrchen mit Gel gegeben werden (z. B. Transystem®), um ein Absterben der Erreger durch Austrocknen oder Nährstoffmangel zu vermeiden. Die gebräuchlichen Transportröhrchen enthalten ein farbloses oder schwarzes (Aktivkohle-) Gel, in welches der Tupfer eingebracht wird.
Die Lagerung und der Transport von Wundabstrichen erfolgt bei Raumtemperatur.
3.7.1. Chlamydien- und Neisserien-Nachweis
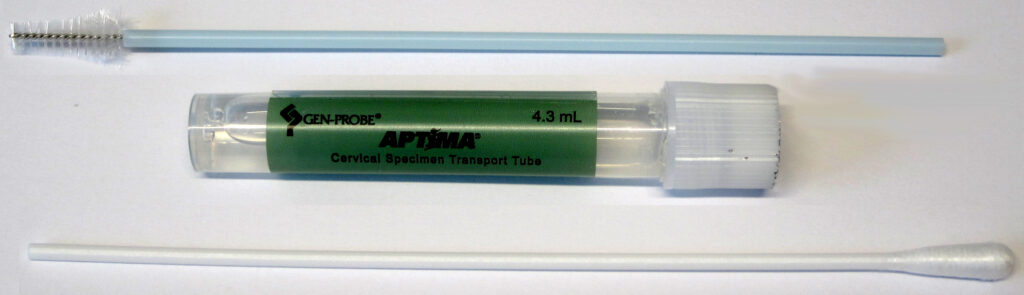
Die Diagnostik erfolgt mittels eines Nukleinsäure-Amplifikationsverfahrens. Hierzu wird ein spezieller Aptima®Genitalabstrich der Firma Hologic benötigt. Im Folgenden finden Sie die Anleitung zur Gewinnung endozervikaler Abstrichproben:
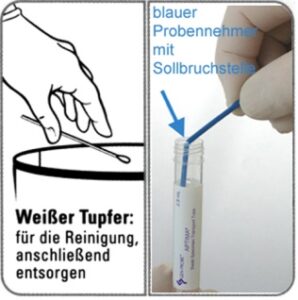
- Schleimreste vom Muttermund und der umliegenden Schleimhaut mit dem Reinigungstupfer (Tupfer mit weißem Schaft in der Packung mit rotem Aufdruck) entfernen. Diesen Tupfer dann verwerfen (s. Abb. 11a) !!
- ein APTIMA® Probentransportröhrchen (lila Aufdruck) mit Name, Vorname und Geburtsdatum der Patientin beschriften
- den Probensammler (mit blauem Schaft in der Packung mit grünem Aufdruck) in den Endozervikalkanal – bei männlichen Patienten entsprechend in die Harnröhre – einführen (s. Abb. 11b und c)
- den Probensammler im endozervikalen Kanal respektive der Harnröhre 10 bis 30 Sekunden lang vorsichtig im Uhrzeigersinn drehen, um die Entnahme einer ausreichenden Probenmenge zu gewährleisten
- den Schraubdeckel vom Probentransportröhrchen abschrauben und den Probensammler sofort in das Probentransportröhrchen geben
- den Schaft des Probensammlers vorsichtig an der Einkerbung abbrechen; darauf achten, den Inhalt nicht zu verspritzen (s. Abb. 11a)
- das Probentransportröhrchen nun wieder gut verschließen
 |  |  |
3.8. Stuhl
Für einen Erregernachweis aus Stuhl sollte mit dem Löffelchen aus dem Probengefäß (Stuhlröhrchen) eine ca. erbs- bis kirschgroße Portion entnommen und in das Probengefäß gegeben werden. Bei flüssigem Stuhl ca. 1 ml mit einer Spritze aufnehmen und in ein Stuhlröhrchen geben. Das Röhrchen fest verschließen und in eine Transportverpackung geben (niemals Stuhlprobe direkt in Transportverpackung geben, da diese nicht steril ist und u. U. bakterizide Substanzen abgibt). Die Beschriftung erfolgt auf dem Röhrchen, nicht auf der Transportverpackung!
Bei Diarrhoe nach antibiotischer Vorbehandlung oder nach Auslandsaufenthalt unbedingt entsprechenden Vermerk auf dem Auftragsschein machen, da in diesen Fällen spezielle Verfahren bzw. Nährmedien verwendet werden müssen.
Für eine Untersuchung auf bakterielle Enteritiserreger sind in der Regel 2 Proben von unterschiedlichen Tagen ausreichend. Bei Verdacht auf Infektion mit Darmparasiten sollten 3 Proben von unterschiedlichen Tagen eingesandt werden (Proben nicht sammeln, sondern jeweils am selben Tage ins Labor schicken).
Die Lagerung bis zum Transport erfolgt gekühlt. Dies verhindert die Überwucherung der enteropathogenen Erreger durch die physiologische Stuhlflora.
Bezüglich der klinisch-chemischen Parameter und der serologischen Diagnostik siehe Kap. 2.4.
3.8.1. Nachweis von Madenwürmern (Oxyuren)
Das Weibchen des Madenwurms wandert in der Nacht zur Eiablage zum Anus. Diese Eier können im Klebefilm-Präparat von der Analhaut lichtmikroskopisch nachgewiesen werden.
Probennahme:
- Durchsichtigen Klebefilm (z. B. Tesafilm, ca. 5 cm) mehrfach mit der Klebeseite auf die Analhaut drücken und abziehen.
- Streifen anschließend straff (möglichst faltenfrei und ohne Einschluss von Luftblasen) auf einen Glasobjektträger kleben.
- Objektträger in bruchsicherem Gefäß einschicken.
Bitte unbedingt beachten:
Probennahme morgens direkt nach dem Aufstehen und vor dem Waschen des Perianalbereichs, da ansonsten die Eier abgespült werden.
3.9. Helicobacter pylori-Kultur aus Magenbiopsien
H. pylori ist extrem empfindlich gegenüber Umwelteinflüssen (vor allem Exposition gegenüber Luftsauerstoff, Nährstoffmangel, Austrocknung). Der kulturelle Nachweis gelingt nur dann zuverlässig, wenn folgende Vorgaben eingehalten werden:
- Antibiotika mind. 4 Wochen und Protonenpumpenhemmer mind. 2 Wochen vor Probenentnahme absetzen
- Verwendung des Transportmediums „Portagerm Pylori“ (kleines Schraubgläschen mit Gel-artigem Transportmedium)
- CAVE: Dieses Transportmedium hat nur eine kurze Haltbarkeitsdauer (siehe Aufdruck auf dem Gefäß); diese darf keinesfalls überschritten werden!
- Bitte bei geplantem Eingriff mindestens 3–4 Tage vorher frisches Medium unter Tel.: 0711 6357-154 / -150 anfordern.
- Biopsieentnahme: möglichst keine Entschäumer einsetzen (bakterizide Wirkung); mind. je eine Biopsie aus dem Antrum (große Kurvatur) und dem Corpus entnehmen, da die Verteilung in der Magenschleimhaut nicht homogen ist. Biopsien für Mikrobiologie vor den Proben für die Pathologie entnehmen, da eine Kontamination mit Formalin vermieden werden muss.
- Die Biopsien müssen mind. 1 cm in das Medium eingedrückt werden, um Kontakt mit Luftsauerstoff zu vermeiden.
- Das Transportmedium mit der Biopsie muss innerhalb von 24 h im Labor eintreffen! Die Untersuchungsdauer beträgt inkl. Empfindlichkeitsprüfung ca. 10 Tage.
3.10. Spermaproben
Bei Entzündungen von Prostata und Samenwegen kann die bakteriologische Untersuchung einer Spermaprobe angezeigt sein. Spermaproben werden häufig durch Keime aus der Harnröhre massiv verunreinigt und sind dann nicht mehr beurteilbar. Gelegentlich sind in Folge einer antibiotischen Vorbehandlung noch antibakteriell wirksame Substanzen vorhanden, die ebenfalls das Ergebnis verfälschen können.
Einen aussagekräftigen Befund kann das mikrobiologische Labor deshalb nur dann erstellen, wenn einige Regeln bei der Probengewinnung eingehalten werden:
- Antibiotika mindestens eine, besser zwei Wochen vorher absetzen
- vor Untersuchung 5 Tage Enthaltsamkeit
- keine Präservative verwenden (antibakterielle Wirkung)
- Verunreinigung durch Keime aus dem vorderen
Bereich der Harnröhre verringern:
- unmittelbar vor der Probengewinnung Blase entleeren (Spüleffekt)
- anschließend Harnröhrenöffnung und Umgebung sorgfältig 3–4 mal mit jeweils einem frischen Tupfer und etwas sterilem (z. B. abgekochtem) Wasser reinigen (KEIN Desinfektionsmittel/KEINE Seife verwenden)
- Ejakulat direkt in sterilem Gefäß (z. B. Urinbecher) auffangen
- die Probe sollte innerhalb von 1 h (max. 4 h) im Labor eintreffen (Transport z. B. durch den Patienten selbst)
Für Spermiogramme (Fertilitätsdiagnostik nach WHO-Kriterien) gelten andere Vorgaben. Das Sperma muss hierfür nach vorheriger Terminvereinbarung in den Räumen des Labor Enders gewonnen werden (bitte vorab unter 0711 6357-0 informieren).
3.11. Diagnostik bei V. a. Dermatomykosen
Entscheidend für die Qualität des mykologischen Befundes ist die korrekt durchgeführte Materialgewinnung. Bei Verdacht auf Haut-, Haar- oder Nagelmykosen senden Sie bitte das nach den Vorgaben von Tab. 12 gewonnene Material ein.
Die Proben werden in ein neutrales, steriles Schraubröhrchen ohne weitere Zusätze gegeben. Die Proben sollten innerhalb von 2 Tagen im Labor sein, da viele Pilzarten empfindlich gegenüber Austrocknung und Nährstoffmangel sind.
| Haut | Haare | Nägel | |
| Was? | möglichst viele kleine Hautpartikel bzw. Schuppen | abgebrochene bzw. glanzlose Haare | möglichst viele kleine Nagelspäne, keine ganzen Nägel! |
| Wo? | Übergang zwischen befallener und gesunder Haut | Randbereich der Läsion | Übergang zwischen befallenem und gesundem Nagelbereich |
| Wie? | Haut mit 70 % Alkohol vorsichtig abtupfen; mit scharfem Löffel oder mit dem Skalpell Hautpartikel/Schuppen abschaben | mit Epilierpinzette herausziehen | Zerstörtes Nagelgewebe mit Schere, Skalpell, scharfem Löffel oder Fräse weitgehend entfernen. An der Übergangsstelle feine Späne mit Skalpell, Schere oder Kürette entnehmen. |
| Wie? | möglichst viel | mind. 10 Einzelhaare | möglichst viele Späne |
Die Diagnostik kann neben dem kulturellen Erregernachweis auch mittels NAT (PCR) durchgeführt werden. Den Untersuchungsauftrag hierfür finden Sie auf unserer Website unter „Dermatomykosen (PCR)“.
https://www.labor-enders.de/dermatomykosen.html
4. Virologie (Erregernachweis)
Für virologische ebenso wie für bakteriologische oder parasitologische Untersuchungen bitte getrennte Proben in separaten Entnahmegefäßen einsenden.
4.1. Allgemeine Regeln
Für den direkten Virusnachweis werden folgende Methoden eingesetzt:
- Isolierung auf Zellkulturen
- Antigen-ELISA
- molekularbiologische Methoden (z. B. PCR)
Bitte beachten Sie folgende wichtige Hinweise:
- Da in der Zellkultur nur vermehrungsfähige Viren nachgewiesen werden und viele Viren außerhalb des Wirtes ihre Aktivität schnell verlieren, spielt hier die richtige Probenentnahme sowie Lagerung und Transport eine wichtige Rolle.
- Die Probenentnahme ist in der Regel nur in der akuten Erkrankungsphase sinnvoll, d. h. innerhalb der ersten 3–4 Tage nach Symptombeginn.
- Nach der Entnahme muss das Material so schnell wie möglich im Labor eintreffen. Bis zum Versand sollten die Proben bei +4 °C gelagert werden.
- Die Proben dürfen bei Raumtemperatur transportiert werden.
- Wenn der Versand innerhalb von 72 Stunden nicht möglich ist, müssen die Proben bei –70 °C eingefroren und gelagert werden. Proben niemals nur bei –20 °C! einfrieren! Der Versand erfolgt auf Trockeneis.
- Die PCR ist eine sehr sensitive Methode. Um Kontaminationen, d. h. falsch-positive Ergebnisse, zu vermeiden, sollten Proben unter Gebrauch von frischen Einmalhandschuhen entnommen und in separate Probengefäße eingebracht werden. Das Wiederöffnen der Gefäße und Umfüllen ist strikt zu vermeiden.
- Austrocknen der Proben vermeiden (betrifft die Isolierung auf Zellkulturen und den Nachweis mittels Antigen-ELISA): Bei Austrocknungsgefahr sollte das Virustransportmedium (rote Flüssigkeit in Röhrchen mit grüner Kappe) verwendet werden. Nur im Notfall, wenn ein Virustransportmedium nicht vorhanden ist, kann physiologische Kochsalzlösung verwendet werden.
- Proben für die Molekularbiologie können auch als trockene Abstriche, jedoch nicht in Gelmedium (nur für bakteriologische Abstriche geeignet) versandt werden.
4.2. Probenentnahme und Transportbehälter
4.2.1. Blutproben
Für die PCR eignet sich insbesondere EDTA-Blut. Der Gebrauch von Heparinröhrchen ist nicht möglich → Heparin hemmt die PCR-Reaktion! Auch für den direkten CMV-pp65-Antigennachweis werden EDTA-Blutproben benötigt (2 ml).
4.2.1.1. Blutproben für die NAT-Testung aus Blutproben von Lebendspendern mittels Procleix Ultrio Assay (TMA) für HBV, HCV und HIV 1/2
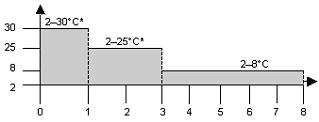
In K2EDTA-, K3EDTA- oder in Becton-Dickinson EDTA-PPTs (Plasma Preparation Tubes, BD PPT™) gesammeltes Plasma kann verwendet werden. Vollblut, Plasma oder Serum kann bis zu 72 Stunden ab Zeitpunkt der Entnahme bei ≤ 25°C gelagert werden; Temperaturen von bis zu 30°C sind über maximal 24 Stunden zulässig. Die Proben können weitere 5 Tage bei 2°C bis 8°C im Anschluss an die Zentrifugation gelagert werden. Plasma, von dem die Zellen abgetrennt wurden, kann längere Zeit bei ≤ -20°C gelagert werden, bevor es getestet wird. Vollblut nicht einfrieren.
4.2.2. Urinproben
5–10 ml frisch gewonnenen Mittelstrahlurin in Urin-Monovette geben.
4.2.3. Stuhlproben
Für den Virusnachweis wird 1–3 g bzw. 1–3 ml Stuhl, wie für bakteriologische Untersuchungen beschrieben, entnommen und in ein separates Stuhlröhrchen bzw. Stuhl-Monovette eingebracht.
4.2.4. Punktate
Punktate (z. B. Pleura-Flüssigkeit, Aszites und Fruchtwasser) werden steril abgenommen und nativ verschickt. Für den Transport kann eine steril „abgestöpselte“ Spritze verwendet werden. Aspirierte Luft ist wieder zu entfernen, um Aufkonzentration durch Verdunstung zu verhindern. Bei geringen Mengen bitte eine „Insulinspritze“ verwenden.
Für Punktate bzw. Wundsekrete zur Bestimmung von β-Transferrin (Nachweis einer Liquorrhoe) gelten die gleichen Empfehlungen. Es sollten jedoch mindestens 100 µl Punktat eingesandt werden. Tamponaden, aus denen das Wundsekret erst herausgewaschen werden muss, sind in der Sensitivität geringen Mengen aspirierten Wundsekrets in Spritzen unterlegen.
Bläscheninhalt mit einer Tuberkulinspritze aspirieren, anschließend in ein Röhrchen mit Virustransportmedium entleeren und die Spritze damit ausspülen.
4.2.5. Abortmaterial, Gewebe und Biopsie
Wenn keine Austrocknungsgefahr besteht, kann das Material nativ in einem neutralen sterilen Röhrchen oder Becher an das Labor geschickt werden (ggf. etwas sterile NaCl-Lsg 0,9% hinzufügen). Andernfalls soll das Virustransportmedium verwendet werden.
4.2.6. Liquor, flüssige Proben aus dem Respirationstrakt
Liquor und flüssige Materialien (2 ml) aus dem Respirationstrakt (Bronchiallavage, Nasen- und Rachenspülwasser, Nasen- und Rachensekret, Speichel, Sputum) sollen in einem neutralen sterilen Röhrchen verschickt werden.
4.2.7. Abstriche
Für die Abstrichentnahme sollen normale Tupfer aus Baumwolle, Dacron, Rayon oder am besten Nylon-Flockfaser verwendet werden. Keine Calcium-Alginat-Tupfer verwenden! Calcium-Alginat-Tupfer können auf Viren toxisch wirken.
Der Abstrich sollte sofort in ein Röhrchen mit Virustransportmedium eingebracht werden. Der Tupfer wird mit einer Schere so weit gekürzt, dass die Kappe dicht schließt und der Tupfer im Transportmedium verbleibt. Trockene Abstriche und bakteriologische Abstriche, die ein Gel oder Agar-Transportmedium enthalten, sind für den Virusnachweis nicht geeignet!
4.2.7.1. Nasen-, Rachen- und Nasen-Rachen-Abstrich
Zum Nachweis humaner Influenzaviren scheint vor allem ein tiefer Nasen-Rachen-Abstrich – insbesondere bei Kleinkindern – sinnvoll, aber auch ein Rachenabstrich ist möglich.
Rachenabstrich:
Mit dem Nylon-Flockfasertupfer oder dem Wattestieltupfer wird unter drehenden Bewegungen ein Abstrich von der Rachenschleimhaut entnommen, entweder unter Aufwendung von Druck abgestrichen oder der Tupfer wird beim Abstreichen gedreht (Tonsillen und Rachenhinterwand).
Nasen-Rachenabstrich:
Den Kopf leicht zurück beugen und den dünnen Abstrichtupfer aus biegsamem Draht sanft über den Nasenraum in den Nasopharynx einführen. Dabei entsteht ein Hustenreiz! Die „Einführtiefe“ sollte etwa der halben Distanz zwischen Nasenflügel und Tragus entsprechen. Den Abstrichtupfer mehrmals rotieren und dann rasch entfernen.
4.2.7.2. Genitalabstrich
Bei offenen Ulcera oder Läsionen wird mit dem Nylon-Flockfasertupfer ein Abstrich vom Wundgrund gemacht. Die Materialentnahme soll gezielt unter Vermeidung einer Kontamination durch Standortflora des umgebenden Gewebes erfolgen.
4.2.7.3. Augenabstrich
Zur Abstrichentnahme ist eine lokale Betäubung der Bindehaut durchaus hilfreich. Dafür sollten möglichst konservierungsfreie Präparate eingesetzt werden, um eine Virusinaktivierung in den Proben zu vermeiden (z. B. Oxybuprocain Augentropfen – Conjuncain® EDO®). Den Tupfer zuerst gut mit steriler physiologischer Kochsalzlösung befeuchten, mehrfach über die Konjunktiva streichen, erst dann in das Virustransportmedium aus dem Röhrchen mit der grünen Kappe geben.
4.2.8. Nachweis humaner Papillomaviren (HPV) aus zervikalen Abstrichen
Aufgrund der deutlichen Abweichung gegenüber der oben beschriebenen Vorgehensweise wird die Probengewinnung für HPV-Diagnostik im Folgenden gesondert beschrieben.
4.2.8.1. HPV-RNA-Nachweis (Testart TMA)
Zum nicht typspezifischen Nachweis der viralen Onkogene E6 und E7 der 14 wichtigsten High-Risk HPV Typen. Bitte unbedingt das spezielle APTIMA® Entnahme- und Transportsystem benutzen. Den weißen Tupfer zum Entfernen von exzessivem Mucus und bitte nur die blaue Cytobrush für den Abstrich verwenden. Diese dann im Röhrchen ausschütteln und dann verwerfen.
4.2.8.2. HPV-Genotypisierung (Testart PCR)
Dient zum typspezifischen HPV-DNA-Nachweis der 24 gängigsten High- und Low-Risk HPV-Typen. Der Abstrich erfolgt unter Verwendung unseres Virustransportmediums mittels normalem Tupfer oder Cytobrush.
4.2.8.3. HPV-Nachweis typspezifisch (Testart PCR)
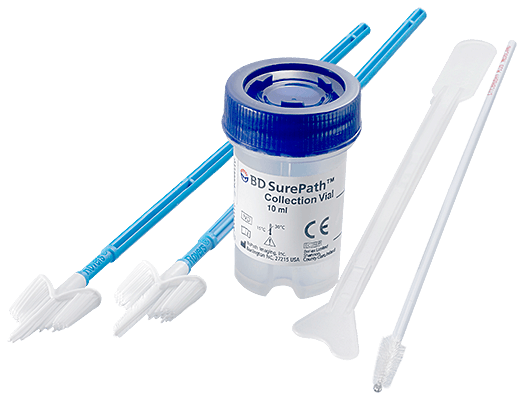
Dient dem Nachweis der DNA von 14 High-Risk HPV-Typen. Als Einzelnachweis (Typen 16, 18, 31, 45, 51, 52) sowie als Gruppennachweis (Typen 33/58 (G1), 56/59/66 (G2) und 35/39/68 (G3). Die Probenentnahme erfolgt mit einem Surepath collection vial für HPV-DNA.
4.2.8.4. Empfohlene Vorgehensweise bei zervikalen HPV-Abstrichen
Die Cytobrush nicht bei schwangeren Frauen verwenden!
Die Entnahme des Pap-Abstriches erfolgt vor der Probengewinnung für den HPV-Test. Bei Durchführung einer Kolposkopie ist der HPV-Abstrich vor Applikation von Essigsäure oder Jod zu gewinnen.
- Exzessiven Mucus mit einem Wattetupfer entfernen
- Entnahme des (epithelzellhaltigen) Abstrichs
- Abstrichträger in das Transportröhrchen überführen, dabei Kontakt mit der Außenseite des Röhrchens oder einem anderen Gegenstand vermeiden
- Den Schaft des Abstrichträgers an der Bruchstelle abbrechen oder abschneiden. Nur der epithelzellhaltige Teil des Abstrichträgers verbleibt im Röhrchen. Das Röhrchen nun gut verschließen.
5. Entnahme-Systeme
Die hier bildlich dargestellten Entnahmesysteme sind nur als Beispiel gedacht und können bei anderen Herstellern anders aussehen.
Sind Handelsnamen in der Bildunterschrift genannt, müssen exakt diese Entnahme-Systeme verwendet werden, da es die Methode erfordert.
5.1. Parameter aus Serum
Serum-Monovetten haben ein Füllungsvolumen von 7,5 ml. Bitte beachten Sie: Die Volumenangaben im Leistungsverzeichnis beziehen sich immer auf das benötigte Serumvolumen. Dies entspricht etwa nur der Hälfte des Vollblutvolumens. Falls keine Gel-Monovette verwendet wird, muss in ein neutrales Röhrchen umgefüllt werden (s. Abb. 24).


Abb. 13: Vollblut-Monovetten zur Serumgewinnung (mit und ohne Gel)
5.2 Parameter aus EDTA-Blut bzw. EDTA-Plasma
EDTA-Monovetten (rote Kappe) gibt es in verschiedenen Größen. Für Anforderungen aus EDTA-Blut reichen in der Regel die 2,7 ml Monovetten aus. Für die Bestimmung der Blutgruppe benötigen wir eine separate 7,5 ml EDTA-Monovette. Werden mehrere Parameter aus EDTA-Plasma angefordert, sollte beachtet werden, dass bei Entnahme von 2,7 ml EDTA-Blut etwa nur 1,3 ml Plasma gewonnen werden können. Bei Verwendung einer EDTA-Gel-Monovette stehen zelluläre Blutbestandteile nicht mehr für Bestimmungen zur Verfügung (z. B. für genetische Untersuchungen mittels PCR).


(EDTA-Gel-Monovetten sind nur in der 4,9 ml und der 7,5 ml Version erhältlich)
5.3. ThromboExact-Monovette bei V. a. Pseudothrombopenie
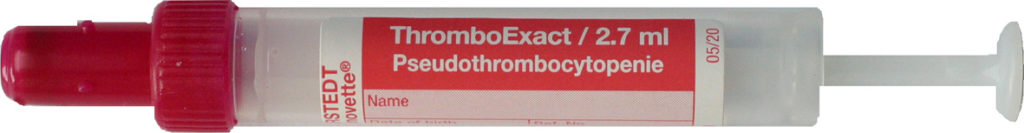
Besteht der V. a. eine EDTA-assoziierte Pseudothrombopenie, kann dies durch Verwendung der ThromboExact-Monovette (blaurote Kappe, Volumen von 2,7 ml) überprüft werden.
5.4 Parameter aus Citratblut bzw. Citratplasma
Citrat-Monovetten (grüne Kappe) für Gerinnungsparameter enthalten eine Na-Citrat-Lösung (0,106 mol/l), die bei komplett gefüllter Monovette das Blut 9+1 verdünnt. Eine exakte Füllung der Citrat-Monovette ist daher sehr wichtig.
Die Bestimmung fast aller Parameter erfolgt immer aus Citratplasma, auch wenn ein Einsenden von Citratblut möglich ist. Einzige Ausnahmen: Thrombozytenfunktionstest und die Thrombozytenzählung bei V. a. EDTA-induzierte Pseudothrombozytopenie. Citrat-Monovetten haben i. d. R. ein Volumen von 2,7 ml. Werden mehrere Parameter aus Citrat-Plasma angefordert, sollte beachtet werden, dass bei Entnahme von 2,7 ml Citratblut etwa nur 1,3 ml Plasma gewonnen werden können. Bei Anforderung vieler Gerinnungsparameter (z. B. Thrombophilie-Abklärung) ggf. das Citratplasma von 2 Monovetten einsenden.

5.5. Parameter aus NaF-Plasma (Natriumfluorid)
Für manche Parameter, die in Blut rasch abgebaut werden, ist das Versenden von NaF-Plasma notwendig. NaF-Monovetten (gelbe Kappe) haben ein Volumen von 2,7 ml. Für die Bestimmung der Glucose wird inzwischen die Verwendung von NAF-Blut, das zusätzlich mit Citrat versetzt wurde, empfohlen (GlucoEXACT s. Kap. 5.5.1, s. unten).

5.5.1. Parameter aus GlucoEXACT-Monovette (Natriumfluorid & Citrat)
Enthält die Monovette neben NaF auch Citrat, wird der initiale Abfall des Glucosespiegels bis zum Eintritt der NaF-Wirkung durch Citrat gehemmt. Die Glucose-Spiegel liegen in der GlucoEXACT-Monovette etwa 3 – 5 % höher als in der reinen NaF-Monovette. Da das Blut in dieser Monovette durch die Citratlösung verdünnt wird, ist eine exakte Füllung der Citrat-Monovette sehr wichtig. Wegen dieser Verdünnung muss der gemessene Glucosespiegel mit dem Faktor 1,16 multipliziert werden.
GlucoEXACT-Monovetten haben ein Endvolumen von 3,1 ml (2,7 ml Blut + 0,4 ml Citratlsg.)

5.6. Parameter aus Li-Heparin-Blut
Heparinmonovetten enthalten Lithium- oder Ammonium-Heparinat zur Hemmung der Blutgerinnung. Die Kappen der Li-Heparin-Monovetten sind orange. Die Granulozytenfunktionsteste, der Interferon-gamma-release assay (IGRA) für die Tuberkulosediagnostik (T-SPOT.TB) und der Toxoplasma gondii-spezifische ELISPOT können nur aus Heparinblut durchgeführt werden. Wir bevorzugten für diese Teste das Lithium-Heparinat als Antikoagulanz. Die Monovetten können beschichtete Kügelchen enthalten, diese stören die Diagnostik nicht.

5.7. Parameter aus Urin



5.8. Liquor und andere Materialien

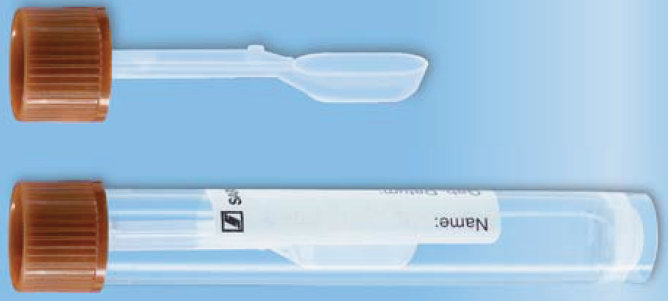
5.9. Parameter aus Stuhl


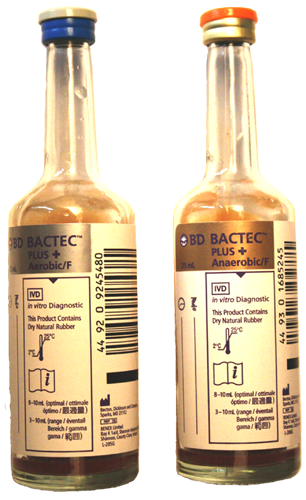
5.10. Blutkulturen, Punktate und Liquor
5.11. Tupfer und Transportbehälter für Abstriche
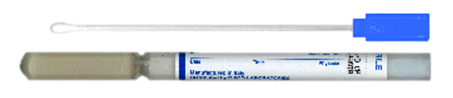


blauer Tupfer mit Sollbruchstelle




5.12. Sputum/Bronchiallavage